
細菌常以包裹在胞外聚合物(EPS)中的生物膜形式存在,使其能抵抗惡劣環境和抗菌治療,導致嚴重感染(如囊性纖維化、癌癥相關感染)并定植于植入物或軟組織(如膽囊、肺)。鼠傷寒沙門氏菌(S. Typhimurium)是此類典型病原體,其生物膜可擴散至深部組織。
傳統生物膜研究多在瓊脂等平面基底上進行,揭示了基底剛度等因素對形態的影響。然而,這些模型無法模擬慢性感染中常見的、嵌入3D環境(如軟組織)的生物膜特性及其增強的耐藥性。早期將細菌封裝在3D水凝膠(如海藻酸鹽)中的研究顯示出更高的生理相關性,但仍受限于營養/氧氣梯度問題。
3D生物打印技術,特別是擠出式打印,為解決上述局限提供了潛力。它可精確制造復雜3D結構,模擬天然組織環境。基于藻酸鹽和明膠等天然聚合物的生物墨水被廣泛探索,但將其用于打印活菌(LM)或生物膜模型仍在發展中,對高細胞密度下生物墨水流變學特性及其如何影響3D環境中生物膜生長的理解尚不足。本研究利用擠出式生物打印,在類組織培養條件下構建3D鼠傷寒沙門氏菌生物膜模型。重點研究了,不同初始細菌濃度對兩種分子量藻酸鹽水凝膠前體流變特性和可打印性的影響。 聚合物分子量和初始細菌密度對細菌存活率、聚集體形成及形態的影響。結果表明,添加不同濃度的細菌對兩種藻酸鹽前體的流變特性無顯著影響,均能實現高可打印性。該3D打印生物膜模型為研究病原菌在類軟組織材料中的相互作用及未來高通量藥物篩選提供了新平臺。
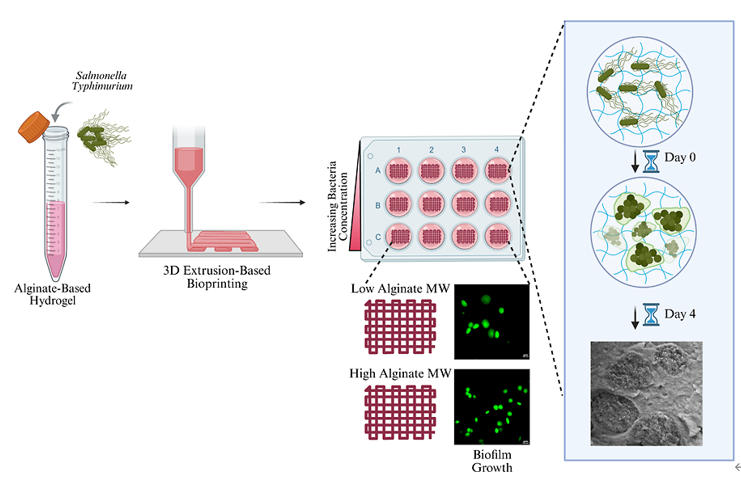
二、材料和方法
采用SunP Biomaker V2進行基于擠出的3D生物打印。水凝膠被打印為10×10×1 mm的結構,該結構通過CAD軟件預先設計,采用直線填充模式,填充密度為20%,層高達0.5 mm。 將無細胞水凝膠裝入3 mL注射器中,在25°C條件下,使用22號錐形尖端針頭(內徑=0.41 mm)進行打印。為表征水凝膠的可打印性,將水凝膠樣品逐層打印在1 mm厚的載玻片上,通過成像評估絲寬和孔徑大小。研究了三種初始接種濃度的鼠傷寒沙門氏菌(1×105、106、107CFU/mL)用于打印載菌結構。將所需濃度的細菌離心pellet,重懸于50 μL 1×PBS中,加入3 mL水凝膠溶液,并用立體移液管反復抽吸混合。載菌水凝膠支架的打印速度為5 mm/s,擠出速率為0.6 mm3/s。生物打印結構用5%(w/v)CaCl?溶液交聯4分鐘,用PBS溶液沖洗兩次,然后在添加10% FBS的DMEM培養基中,于37°C、5% CO2條件下培養。隨后對載菌結構進行為期4天的培養成像。
三、結果與討論
3.1 水凝膠的流變學
本研究使用兩種藻酸鹽-明膠水凝膠,5%LA-5%Gel(含24 kDa低分子量藻酸鹽)和1.5%MA-5%Gel(含773 kDa高分子量藻酸鹽)。交聯前(CaCl2交聯前),兩者在25°C下表現出相似的起始流變特性(圖2a),但凝膠時間不同(儲能模量與損耗模量交點分別在6分鐘和12分鐘)。兩者均表現為粘彈性固體(G' > G'', 圖2b)并具有剪切稀化行為(圖2c)。然而,經5% CaCl2交聯并在37°C下測試后,5%LA-5%Gel的儲能模量(~4.74 kPa)顯著高于1.5%MA-5%Gel(~2.73 kPa),表明其網絡交聯更致密(圖2d)。應力松弛測試(10%應變,圖2e)顯示1.5%MA-5%Gel保留的初始應力比例更高(~39% vs ~25%),松弛過程更慢,回彈性更好。而5%LA-5%Gel松弛更快。這些流變學差異主要歸因于藻酸鹽分子量的不同,符合低分子量聚合物導致更快松弛的文獻報道。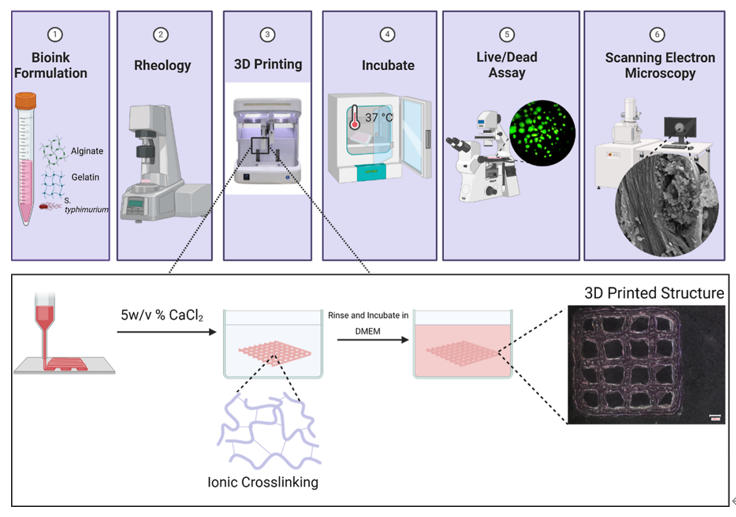
圖1. 鼠傷寒沙門氏菌(S. Typhimurium)水凝膠制備與表征示意圖。
圖2. 未包埋細菌的水凝膠前驅體流變特性。
3.2 封裝細菌濃度的影響
將不同濃度(1×105至1×1010 CFU/mL)的鼠傷寒沙門氏菌封裝入兩種藻酸鹽-明膠水凝膠前體(5%LA-5%Gel和1.5%MA-5%Gel)中,并在25°C下評估細菌負載量對其粘彈性的影響。結果表明(圖3),細菌濃度≤ 1×107CFU/mL時,對兩種水凝膠的模量(G'和G'')均無顯著影響。然而,濃度達到1×1010 CFU/mL時,兩種水凝膠的模量均顯著下降。該極高濃度下的細菌濃縮物本身(S. Paste)表現出類似彈性固體的行為,其模量遠高于純水凝膠,表明其顯著改變了水凝膠的微觀結構。細菌濃度較低時,水凝膠的剪切稀化行為保持不變。但在高濃度(1×1010 CFU/mL)下,剪切稀化效應增強。純細菌濃縮物的流變行為則與純水凝膠相似,均表現出剪切稀化特性。
