
一、背景介紹
肝移植雖是終末期肝衰竭的金標準,但供體短缺促使探索替代療法。現有組織工程策略(如微囊化、細胞片)難以模擬肝微環境且力學強度不足,限制長期療效。3D生物打印通過精準排布細胞與生物材料,為構建可移植肝組織提供新思路。然而,現有研究多采用肝癌細胞系(如HepG2、HepaRG),其肝特異性功能不足限制了生物打印肝臟組織的功能,且單細胞打印細胞數量有限,細胞互作缺失導致功能衰退。
本研究提出創新策略:結合化學重編程來源的無基因修飾人多能干細胞(hCiPSCs)與球體生物打印技術。通過PDMS基透氣微孔裝置規模化培養高活性肝類器官(hCiPSC-HOs),并基于球體打印構建高密度肝組織模型(3DP-HOs)。相較于單細胞打印,球體打印保留類器官內細胞互作,顯著提升肝功能基因(如ALB、CYP3A4)表達,其功能接近原代肝細胞(PHHs)。體內實驗表明,3DP-HOs在小鼠肝衰竭模型中顯著提高生存率,促進肝再生并緩解纖維化,且通過宿主血管網絡實現長效氧供與代謝支持。該技術為肝再生醫學提供了兼具功能性與穩定性的新型治療策略。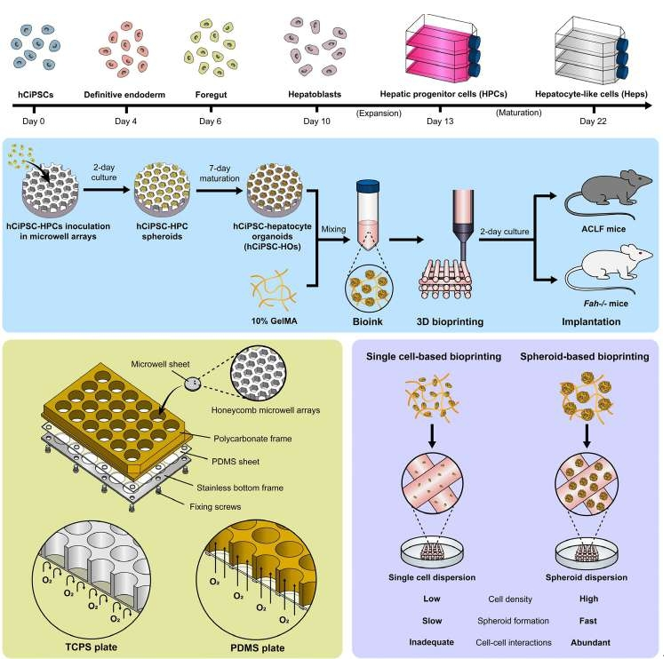
二、結果
2.1 利用透氧微孔裝置制備高功能 hCiPSC-HOs
本研究基于透氧微孔裝置實現功能性肝類器官(hCiPSC-HOs)的規模化制備。hCiPSC-HPCs(96% CK19/AFP雙陽性)經微孔培養自組裝為球體,其直徑(約95 μm)與細胞活性(>90%,前6天)顯著優于傳統2D培養。功能分析顯示,3D球體的白蛋白分泌(峰值9.68±0.65 μg/百萬細胞/24 h)及尿素合成(214.40 ± 31.60 μg/百萬細胞/24 h)于第7天達峰,功能指標接近原代人肝細胞(PHHs)。基因表達(HNF4A、CYP3A4等)與功能實驗(ICG代謝、脂質代謝等)證實hCiPSC-HOs具備成熟肝細胞特性,并形成膽管樣極性結構。該技術為構建生物打印肝模型提供了高活性功能單元。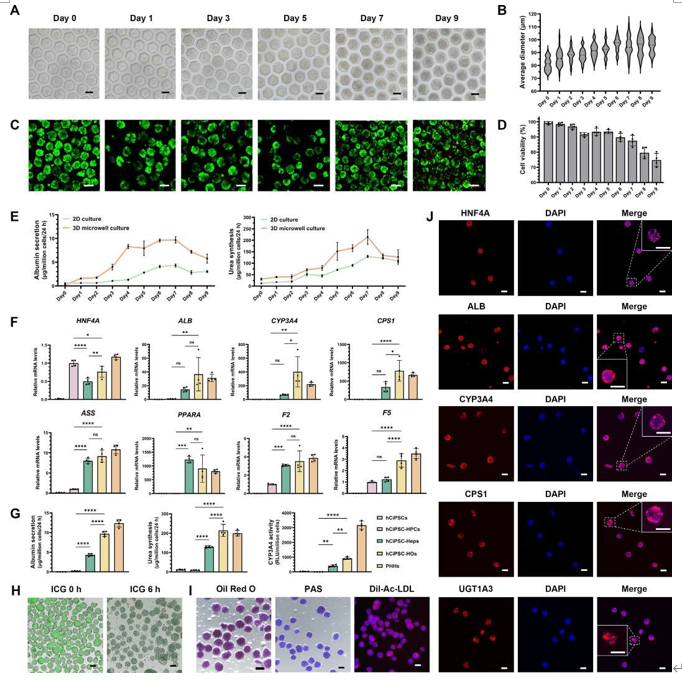
圖3. 基于球體的生物打印肝組織模型確保了 hCiPSC-HOs 的高活性和生物功能。
2.3 RNA測序分析表明hCiPSC-HOs與3DP-HOs基因表達譜相似且肝功能增強
通過RNA測序比較多種細胞模型的基因表達特征,研究發現:hCiPSC-HOs與3DP-HOs在PCA和層次聚類中呈現高度相似性(圖4A-B),證實生物打印過程未顯著改變基因表達。差異分析顯示,3DP-HOs較hCiPSC-HOs在膽汁分泌、細胞黏附和氧響應相關基因表達增強,但與PHHs相比,其免疫活性及細胞色素P450介導的藥物代謝能力較弱,而膽固醇/脂肪酸代謝功能更強(圖4A)。值得注意的是,hCiPSC-HOs和3DP-HOs的基因表達與PHHs的差異顯著小于hCiPSC-Heps。進一步分析發現,hCiPSC-HOs較hCiPSC-Heps呈現肝臟功能基因上調(332個共同差異基因),尿素循環相關通路顯著激活,同時肝祖細胞和炎癥標志物下調(圖4C-F)。熱圖顯示3DP-HOs與hCiPSC-HOs在尿素循環和代謝轉錄因子表達上明顯高于其他組,而肝祖細胞標志物表達更低(圖4G-H)。GSEA證實hCiPSC-HOs在氨基酸分解代謝和PPAR信號通路上具有優勢(圖4I)。綜上所述,hCiPSC-HOs經生物打印后仍維持優越的肝臟代謝功能,其成熟度顯著優于hCiPSC-Heps。
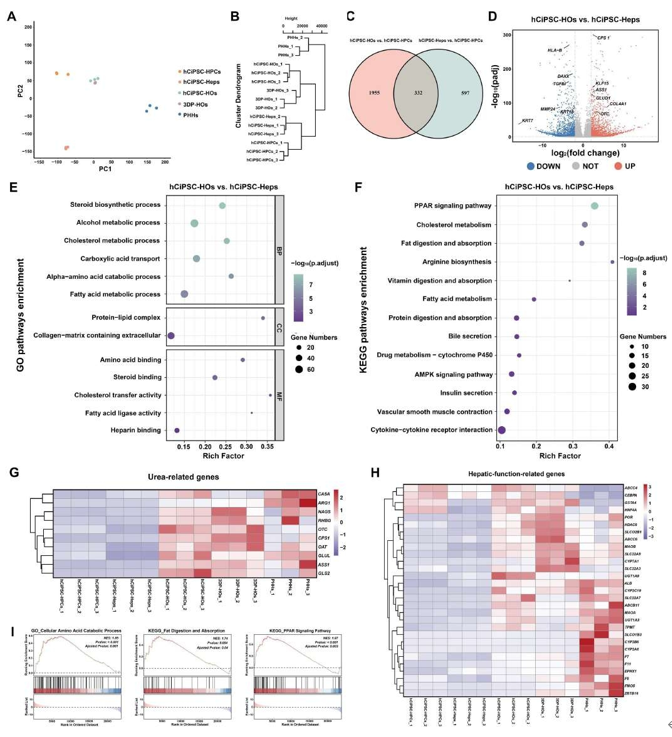
圖 4. RNA測序分析顯示hCiPSC-HOs與3DP-HOs基因表達譜相似且肝功能增強
2.4 3DP-HOs移植有效救治CCl4誘導的慢加急性肝衰竭小鼠
將3DP-HOs植入CCl?誘導的急性慢加急性肝衰竭(ACLF)小鼠模型(圖5A)后,治療組7天生存率達85.7%,顯著優于無細胞假手術組(0%)及空白組(0%)。植入肺癌細胞來源的3DP-A549組小鼠7天內全部死亡,證實3DP-HOs療效具有細胞特異性。3DP-HOs組生存率與正常對照組無差異(圖5B),且血清中人白蛋白(hALB)水平顯著高于PHH移植組(第1/7天分別為26和32 μg/mL,圖5C)。該組肝損傷標志物(ALT、AST等)在7天內恢復至正常水平(圖5D),H&E及TUNEL染色顯示肝組織壞死、充血及凋亡減少,Masson等染色證實纖維化顯著緩解(圖5E)。
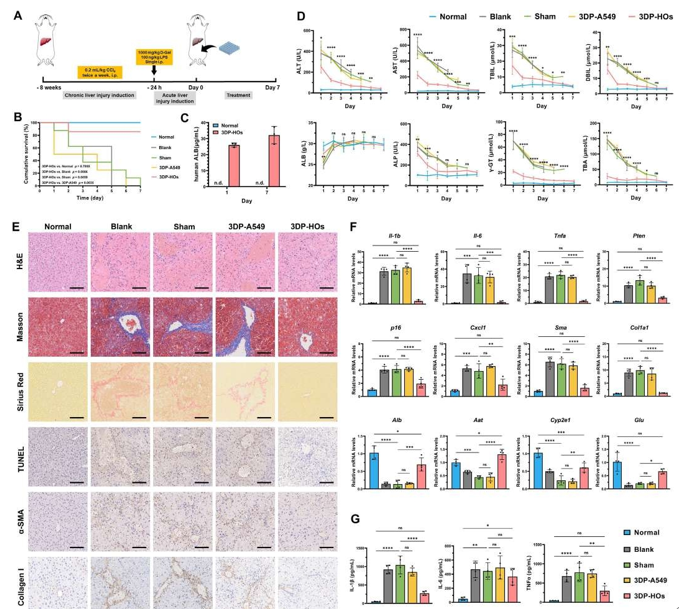
圖 5. 3DP-HOs植入挽救CCl?誘導的慢加急性肝衰竭(ACLF)模型小鼠。
2.5 3DP-HOs移植挽救Fah?/?肝衰竭小鼠
將3DP-HOs植入模擬人類I型酪氨酸血癥的Fah?/?肝衰竭小鼠模型(圖6A)。治療60天后,3DP-HOs組生存率達80%,顯著高于假手術組、空白組及3DP-A549組(均無存活),且體重恢復趨勢與正常對照組相似(圖6B-C)。移植后30天和60天血清中持續檢測到人ALB(圖6D),且分泌水平隨時間遞增,提示3DP-HOs內肝細胞可能在體內微環境中增殖或功能增強。該組肝損傷標志物(ALT、AST等)顯著降低(圖6E),H&E及TUNEL染色顯示肝組織壞死、凋亡減少,Ki67染色證實細胞增殖活躍(圖6F)。基因分析表明,3DP-HOs組炎癥/纖維化相關基因(如Il-1β、Trp53)表達顯著下調,肝功能基因(Alb、Cyp2e1)及增殖基因Mki67上調,部分指標與正常組無差異(圖6G)。盡管血清IL-1β、IL-6和TNF-α水平較假手術組顯著下降,但仍高于正常組,提示殘留炎癥(圖6H)。
進一步評估 3DP - HOs - C2/C19。結果顯示,結果顯示其移植組生存率顯著提高,血清hALB持續分泌,肝損傷標志物降低。組織學分析證實其促進肝再生、減少凋亡及炎癥。3DP - HOs - C1、C2、C19 在兩種肝衰竭小鼠模型中驗證了治療效果,突顯其廣泛適用性及體內治療的巨大潛力。
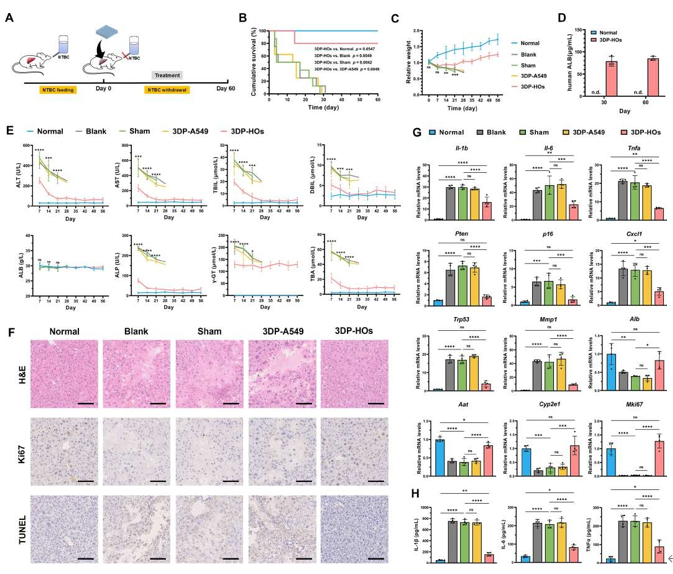
圖 6. 3D生物打印肝類器官(3DP-HOs)移植挽救Fah基因敲除(Fah?/?)肝衰竭小鼠。
2.6 3DP-HOs促進血管生成并維持高細胞活性功能治療Fah?/?肝衰竭小鼠
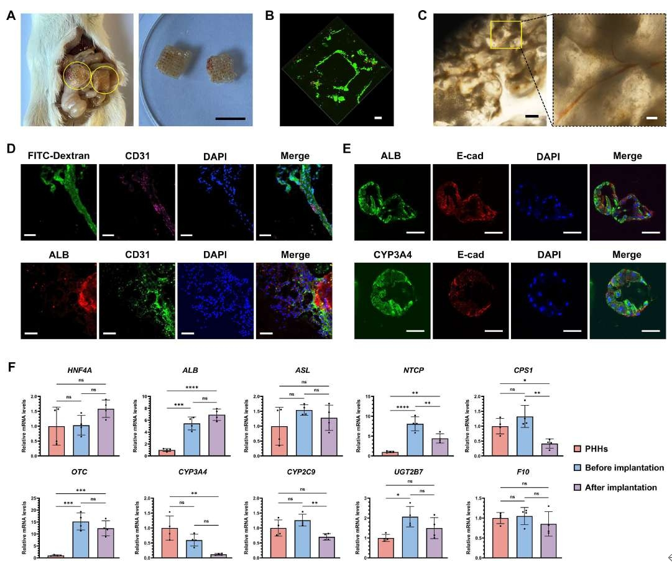
圖 7. 3DP-HOs促進血管化并維持高細胞活性治療Fah?/?肝衰竭小鼠
三、討論
本研究采用基于hCiPSCs的肝類器官(hCiPSC-HOs)結合球體生物打印技術構建功能性肝組織模型(3DP-HOs)。通過PDMS基透氣微孔裝置增強氧供,實現大規模高活性hCiPSC-HOs制備。與傳統方法(如直接肝細胞移植易引發免疫排斥,微囊化移植受限于氧擴散不足)相比,3DP-HOs利用GelMA水凝膠構建網格結構,其互連微通道促進氧/營養傳輸,顯著提高細胞存活率,且植入60天后仍保持完整結構(圖7A),可安全取出。RNA測序顯示,3DP-HOs在打印前后基因表達譜高度一致(圖4A-B),雖較原代肝細胞(PHHs)存在藥物代謝(如細胞色素P450活性)及免疫功能差距,但其成熟度顯著優于hCiPSC-Heps(圖4)。
在CCl4誘導的ACLF及Fah?/?酪氨酸血癥小鼠模型中,3DP-HOs均顯著提高生存率,降低肝損傷標志物及炎癥因子(IL-1β、TNF-α),并緩解纖維化(圖5-6)。長期治療中,3DP-HOs促進肝再生(Ki67表達上調),且通過宿主血管網絡實現氧/營養供給及代謝物清除(圖7C-D)。組織學證實其結構內形成功能性血管(CD31),并與肝細胞(ALB)緊密互作(圖7D)。
未來研究需優化生物墨水:天然水凝膠(如海藻酸、膠原)雖具生物相容性但力學性能不足;合成水凝膠(如PEG)可調控力學但缺乏生物活性。開發合成-天然雜化墨水或動態交聯策略有望平衡性能。規模化應用需解決細胞量(約5×109個)及氧供難題,結合氧釋放材料(CaO2納米顆粒)及灌注生物反應器或可突破限制,推動功能性肝組織模型的臨床轉化。
四、結論
3DP-HOS與使用基于單核的生物打印制造的模型相比,顯示出增強的細胞活力,并表現出與HCIPSC-HOS相似的基因剖面,同時保持乳膠特異性功能。此外,3DP-HOS植入可顯著提高CCL4誘導的急性智力肝衰竭的小鼠的存活率,以及肝衰竭的Fah?/? 小鼠。 3DP-HOS顯著降低了肝損傷,炎癥和纖維化指數,同時促進肝臟再生和生物功能表達。我們的生物打印肝組織模型對肝衰竭具有顯著的治療功效,并具有在肝臟再生醫學領域進行臨床研究的巨大潛力。
五、參考文獻
